Neue Wege beginnen dort, wo alte enden: ein TAVR-Fall
Eine 85-jährige Frau leidet unter Belastungsdyspnoe und Angina pectoris bei einer schweren paradoxen low-flow-low-gradient Aortenklappenstenose, einer ausgeprägten Mitral- und Trikuspidalklappenerkrankung und einer koronaren 2-Gefäßerkrankung. Frailty-Marker und eine ungünstige Beckenanatomie erschweren ihr Krankheitsbild zusätzlich.
Wie würde Ihr Herzteam diesen schwierigen Fall angehen?
Authors
Lernziele
- Aufzeigen der Komplexität der Symptomzusammenhänge bei alten und gebrechlichen Patienten mit Mehrfachklappenerkrankungen
- Verstehen der Bedeutung der multimodalen Bildgebung vor dem Eingriff sowohl für die Diagnose von Mehrfachklappenerkrankungen als auch für die Planung des Eingriffs
- Erlernen eines alternativen perkutanen Zugangs beim transkatheteralen Aortenklappenersatz
Zusammenfassung des Falls und klinisches Erscheinungsbild der Patientin – Wie soll ich behandeln?
Eine 85-jährige Patientin wurde zur Untersuchung einer Aortenklappenstenose aufgenommen. Sie litt seit sechs Monaten unter Belastungsdyspnoe (NYHA-Klasse III) und Angina pectoris (CCS-Klasse II). Sie lebte mit ihrem Ehemann selbstständig in ihrer eigenen Wohnung. In ihrer Anamnese waren eine in Remission befindliche Magenkrebserkrankung und Psoriasis dokumentiert. Sie wies mehrere Anzeichen von Gebrechlichkeit auf, darunter einen BMI von 19,2 kg/m², eine 5-Meter-Gehgeschwindigkeit von 9,8 Sekunden und eine durchschnittliche Griffkraft von 12,7 kg. Die Echokardiographie ergab eine normale linksventrikuläre Ejektionsfraktion und eine schwere paradoxe low-flow-low-gradient Aortenklappenstenose, mit einem mittleren Druckgradienten von 39 mmHg, einer Aortenklappenöffnungsfläche von 0,5 cm² und einem Schlagvolumenindex von 30 ml/m² (Abbildung 1, Videos 1 und 2).
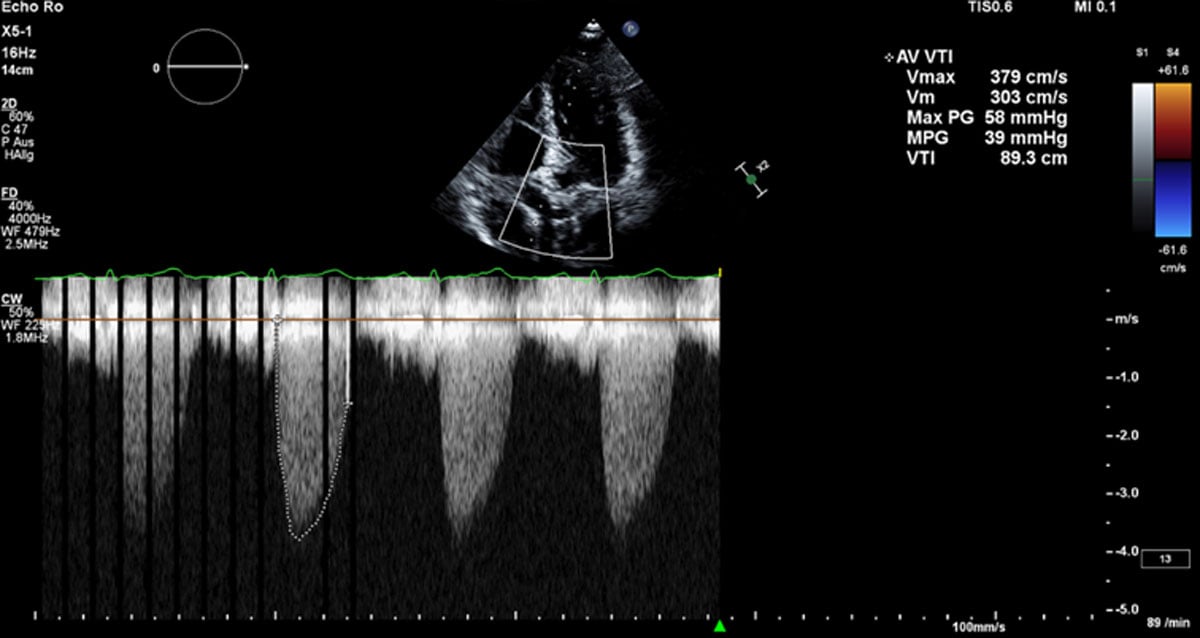
Abbildung 1. Druckgradienten über der stenotischen Aortenklappe
Darüber hinaus war eine schwere Mitralklappenringverkalkung erkennbar, begleitet von einer schweren Mitralinsuffizienz und einer moderaten Mitralstenose. Die Trikuspidalklappe wies eine schwere Trikuspidalinsuffizienz auf (Video 3, Video 4).
Die Koronarangiographie ergab eine Zweigefäßerkrankung mit funktionell nicht signifikanten Stenosen der rechten Koronararterie und der Arteria circumflexa, wie durch RFR-Messungen festgestellt wurde (Video 5, Video 6).
Die Rechtsherzkatheteruntersuchung zeigte eine postkapilläre pulmonale Hypertonie mit einem systolischen/mittleren Pulmonalarteriendruck von 37/29 mmHg und einen pulmonal-kapillären Verschlussdruck von 27 mmHg.
Die Computertomographie ergab einen Aortenklappen-Kalziumscore von 3238 AU, was auf eine schwere Aortenklappenstenose bei niedrigem Fluss hindeutet, und bestätigte zudem das Vorliegen einer schweren Mitralklappenringverkalkung (Abbildung 2).
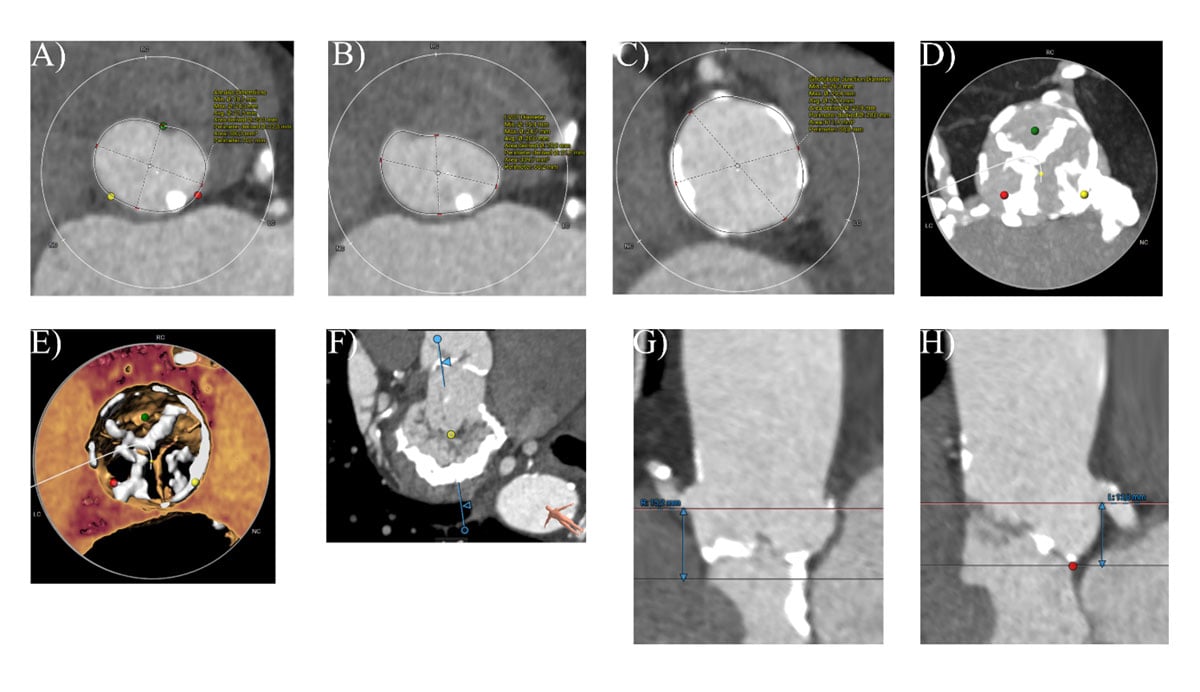
Abbildung 2. CT-Analyse der Aortenwurzel und der begleitenden Strukturen. A) Aortenring B) linksventrikulärer Ausflusstrakt C) Sinutubulärer Übergang D) und E) Ansicht der verkalkten Aortenklappe von der Aorta aus F) schwere Mitralringverkalkung G) Höhe der rechten Koronararterie H) Höhe der linken Koronararterie.
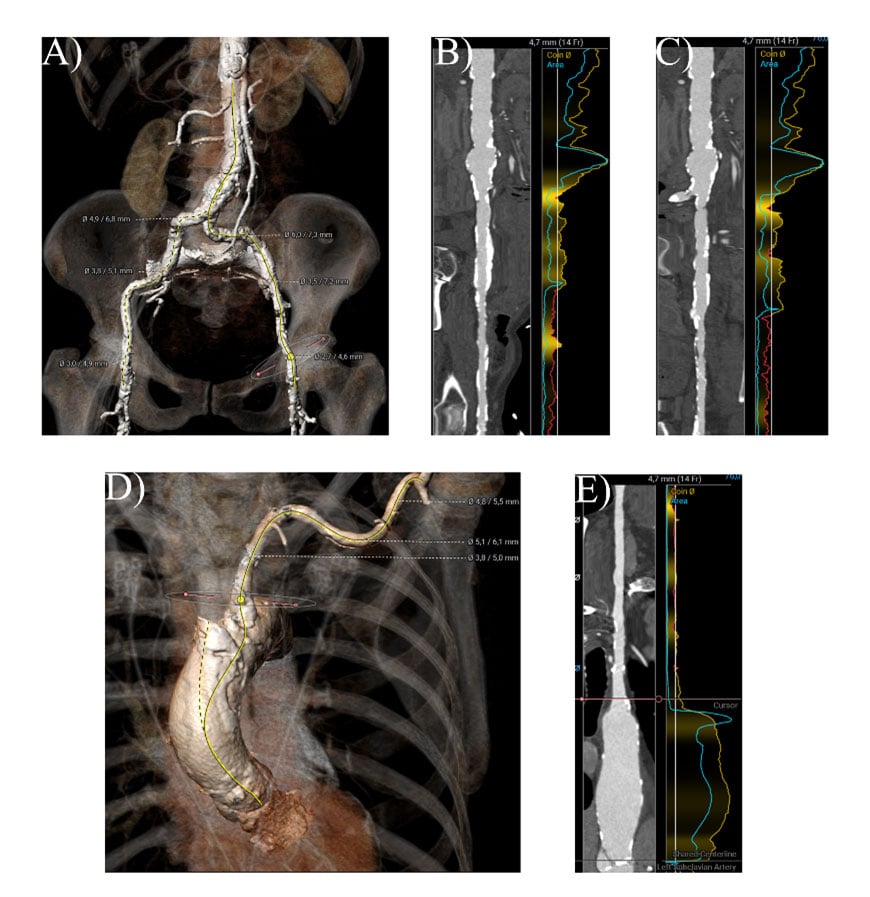
Darüber hinaus stellte sich bei paVK die ungünstige Anatomie der Beckenarterien dar, mit minimalen Lumendurchmessern von 2 mm in der A. iliaca communis, der A. iliaca externa und der A. femoralis communis auf beiden Seiten (Abbildung 3, Video 7, Video 8).
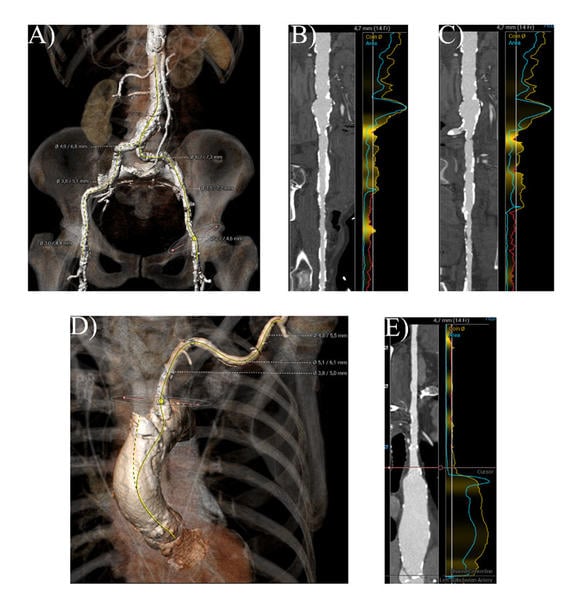
Abbildung 3. CT-Analyse des femoralen und linken axillären Zugangs. A) 3D-Rekonstruktion der Becken- und Femoralarterien B) Snake-Ansicht der rechten Beckenachse C) Snake-Ansicht der linken Beckenachse D) 3D-Rekonstruktion der linken Axillar- und Subclaviaarterie E) Snake-Ansicht des linken axillären Zugangs
Nach einer Besprechung mit dem Herzteam und dem Patienten entschieden wir uns für eine transaxilläre TAVR (Video 9) mit anschließender Neubewertung der atrioventrikulären Klappenerkrankung unter der Annahme, dass sich nach der Korrektur der Aortenklappenstenose eine Verbesserung einstellen würde.
Die Entscheidung gegen eine intravaskuläre Lithotripsie (IVL) für einen transfemoralen Zugang beruhte auf der starken Verkalkung an der Punktionsstelle, die einen sicheren Zugang mit großem Durchmesser selbst nach einer transbrachialen IVL-Therapie unwahrscheinlich machen würden.
Entsprechend dem Wunsch des Patienten wurde der Eingriff unter Vollnarkose durchgeführt. Ein Sicherheitsdraht wurde von der linken Radialarterie zur Bauchaorta gelegt, aber er wurde nicht externalisiert.
Der PigTail-Katheter wurde nach einer ultraschallgeführten Punktion über einen 6F-Zugang über die linke Arteria femoralis communis platziert.
Unter Ultraschall- und Röntgenkontrolle wurde die linke A. axillaris mit einem Mikropunktionsset punktiert.
Nach angiographischer Bestätigung (Video 10) wurde die Zugangsstelle mit einer 6F-Schleuse erweitert, woraufhin ein Perclose vorgelegt wurde.
Anschließend wurde eine 14F-Schleuse mit einem steifen Draht in die A. axillaris eingeführt und bis zur Ao. ascendens vorgeschoben.
Nach Passage der Aortenklappe wurde unter schneller ventrikulärer Stimulation eine Ballondilatation der Aortenklappe mit einem 20-mm-Ballon durchgeführt (Video 11).
Danach wurde eine selbst-expandierende Prothese (25-mm-Navitor Vision) unter Verwendung der integrierten Schleuse eingeführt.
Nach einem partiellen Resheathing aufgrund einer zu tiefen Implantationsposition wurde die Prothese erfolgreich positioniert (Videos 12-15).
Die Angiographie, die invasive Hämodynamik und die transösophageale Echokardiographie zeigten ein sehr gutes Ergebnis mit vollständiger Expansion der Prothese, keinem Restgradienten, keiner paravalvulären Leckage und patenten Koronararterien (Video 16, Video 17).
Nach Entfernung der axillären Schleuse wurde die Punktionsstelle mit dem bereits vorgelegten Perclose Prostyle und einem zusätzlichen 6F AngioSeal verschlossen.
Die Angiographie zeigte eine patente A. axillaris ohne Blutungen und einen guten peripheren Abfluss (Video 18).
Die Punktionsstelle in der linken Arteria femoralis communis wurde mit einem ExoSeal verschlossen, um jegliches Material im Gefäß zu vermeiden, und ein TR-Band wurde an der linken Arteria radialis angelegt.
Der postoperative Verlauf war unauffällig, insbesondere hinsichtlich Blutungen und sensorischen oder motorischen Ausfällen im Zusammenhang mit dem axillären Zugang.
Die Echokardiographie bei Entlassung ergab ein ausgezeichnetes hämodynamisches Ergebnis ohne PVL und einen mittleren Gradienten von 9 mmHg.
Nach 3 Monaten bestätigte eine erste Kontrolle das gute Ergebnis nach TAVI (keine PVL, p-mean 3 mmHg). Die Mitral- und Trikuspidalklappeninsuffizienz verbesserte sich und zeigte nur noch einen moderaten Schweregrad. Wie erwartet blieb eine moderate Mitralstenose bestehen. Die NT-proBNP-Werte sanken von 1798 ng/L auf 1377 ng/L.
Der Patient klagte jedoch über anhaltende Belastungsintoleranz gemäß NYHA III, was darauf hindeutet, dass die Symptome bei alten und gebrechlichen Patienten, die an einer multivalvulären Herzerkrankung leiden und eine Krebsanamnese haben, vielfältig sind.
Aufgrund des deutlich erhöhten Blutdrucks wurde ein konservativer Ansatz gewählt, mit einer Optimierung der blutdrucksenkenden Medikation, da die interventionellen Optionen begrenzt waren.
Die Stellungnahme des eingeladenen Experten
1. Behandlungsstrategie
Bei dieser Patientin handelt es sich um eine 85-jährige Frau, die an einer schweren Aortenklappenstenose und anderen Herzklappenerkrankungen leidet. Sie weißt mehrere Marker für Gebrechlichkeit auf. In Anbetracht der verschiedenen Behandlungsstrategien könnte eine optimale medikamentöse Therapie diskutiert werden, da bei dieser Patientengruppe das Komplikationsrisiko und die Mortalität im Zusammenhang mit einem katheterinterventionellem Aortenklappenersatz (TAVR) höher sind1,2. Die Verbesserung der Symptome und des Schwergrades der begleitenden Mitral- und Trikuspidalklappeninsuffizienz nach TAVR ist schwer vorhersehbar und kann oft erst nach einer gewissen Zeit nach dem Eingriff beurteilt werden. Da die Patientin in ihren täglichen Aktivitäten unabhängig ist und sich aktiv um ihren Ehemann kümmert, ist ein Therapieversuch mit TAVR bei schwerer Aortenklappenstenose gerechtfertigt, mit anschließender Neubewertung der atrioventrikulären Herzklappenerkrankung. Dieser Ansatz zielt darauf ab, den Funktionsstatus und die Lebensqualität zu verbessern, um die Unabhängigkeit weiterhin zu ermöglichen.
Die chirurgische Option bei dieser gebrechlichen, älteren Patientin birgt ein deutlich höheres Risiko für Mortalität, Morbidität, Funktionsverlust und schwerwiegende unerwünschte Ereignisse, insbesondere bei komplexen Eingriffen wie einer Operation an drei Herzklappenm dreifachen Klappenersatz/einer dreifachen Klappenrekonstruktion mit laängerer Zeit an der Herz-Lungen-Maschine Operationsdauer3. In diesem Zusammenhang stellt TAVR einen sinnvollen und akzeptablen Eingriff zur Verbesserung der Symptome und der Lebensqualität dar, insbesondere angesichts ihrer Angina pectoris und des Fehlens einer signifikanten koronaren Herzkrankheit.
2. TAVR und die Wahl des Gefäßzugangs
Der transfemorale Zugang bleibt der Goldstandard für den Gefäßzugang bei TAVR, da er im Vergleich zu anderen alternativen Zugängen mit demn niedrigsten Komplikationsrisikoraten verbunden ist4. Der ideale alternative Zugang für TAVR sollte die perkutane Implantation der Klappe unter bewusster AnalgosSedierung und Lokalanästhesie ermöglichen und gleichzeitig Ergebnisse erzielen, die mit denen des transfemoralen Zugangs vergleichbar sind. Es gibt jedoch keine großen randomisierten Studien, in denen die Ergebnisse alternativer Zugänge verglichen werden, und die aktuellen Empfehlungen basieren weitgehend auf Beobachtungsdaten.Angesichts des höheren Risikos für Komplikationen und Mortalität im Zusammenhang mit dem transapikalen und transaortalen Zugang5,6,7 sind diese Zugänge in der Regel Patienten vorbehalten, für die ein transaxillärer, transkarotisder oder transkavaler Zugang nicht geeignet ist. Die drei letztgenannten , da diese Zugänge weisen in observativen Studien ein vergleichbares Mortalitäts- und Schlaganfallrisiko wie der transfemorale Zugang aufweisen8.
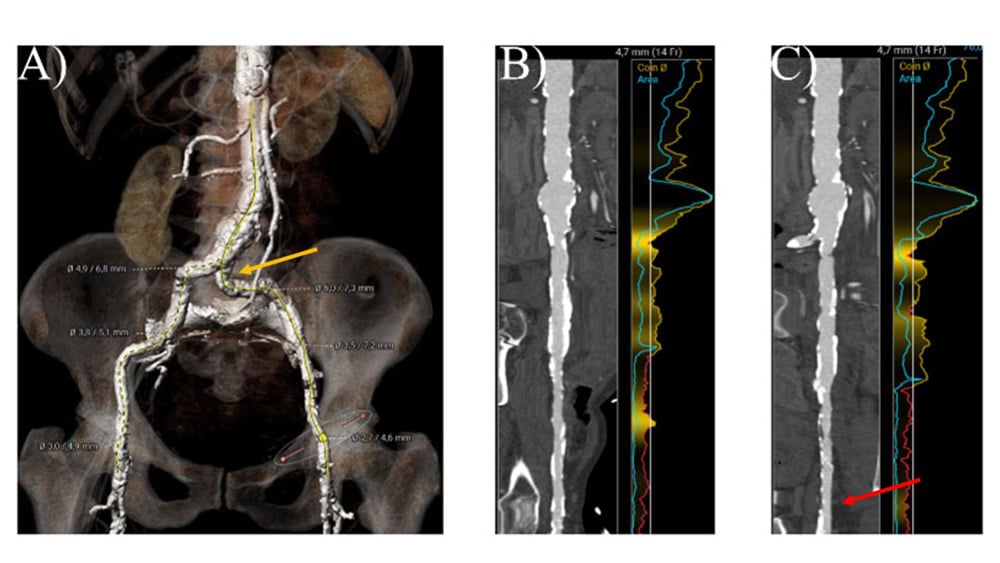
In diesem Fall zeigt die Computertomographie (CT) der Femoralgefäße eine zirkuläre Verkalkung an der Punktionsstelle der rechten Arteria femoralis communis (CFA) (Abbildung 1B) im Vergleich zu einer dorsalen Verkalkung nur an der linken CFA (Abbildung 1C, roter Pfeil). Beide A. iliaca externa zeigen eine Lumenverengung, und die A. iliaca communis links weist eine Kombination aus Knickung und Verkalkung auf (gelber Pfeil).
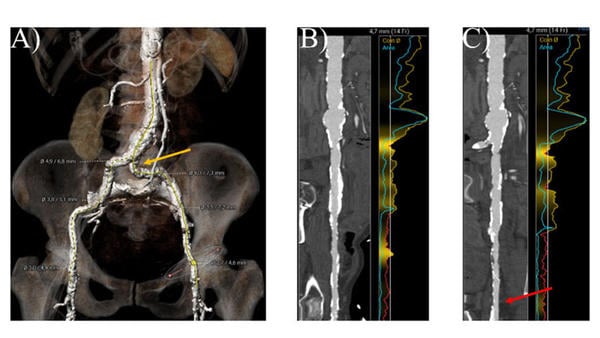
Abbildung 1. CT-Analyse des femoralen Zugangs. A) 3D-Rekonstruktion der Becken- und Femoralarterien B) gestreckte Ansicht der rechten Beckenachse C) gestreckte Ansicht der linken Beckenachse.
Wenn der alternative Zugang in diesem Fall nicht geeignet wäre, könnte nach einer adjuvanten Therapie zur Optimierung des Gefäßzugangs, wie z. B. einer Ballonangioplastie und der Verwendung einer ballonexpandierbaren Schleuse, ein Versuch mit einem linksen femoralen Zugang in Betracht gezogen werden. Die intravaskuläre Lithotripsie kann verkalkte Gefäße sicher modifizieren und das Vorschieben einer Schleuse mit großem Durchmesser erleichtern, wie in der Disrupt PAD III-Studie gezeigt wurde9. Das Vorliegen einer nur dorsalen Verkalkung (ventral keine Verkalkung) der linken CFA könnte macht den Erfolg eines Gefäßverschlusses auf der linken Seite vielversprechender als auf der rechten Seite machen.
Expandierbare Schleusen (z. B. e-sheath – Edwards oder iSLEEVE – Boston Scientific) können bei der Navigation durch gewundene oder verkalkte Beckengefäße helfen, insbesondere bei einer Kombination aus Kinking nickung und Verkalkung. Alle diese Manöver sind jedoch mit einer erhöhten Inzidenz von vaskulären Komplikationen und einer schlechteren Prognose verbunden. Patienten mit peripherer arterieller Verschlusskrankheit, die sich einer transfemoralen TAVR unterziehen, weisen im Vergleich zu Patienten ohne periphere arterielle Verschlusskrankheit höhere Sterblichkeits-, Wiederaufnahmeraten und Blutungsraten auf, ein Trend, der bei Patienten, die über einen alternativen Zugang behandelt werden, nicht beobachtet wird10.
3. Eignung der transaxillären (TAx) TAVR
Aktuelle Daten belegen die relative Sicherheit und Wirksamkeit sowohl des perkutanen als auch des chirurgischen Ansatzes für die TAx-TAVR. Während die axilläre Schnitttechnik chirurgische Freilegung Herzchirurgen aufgrund ihrer häufigen Verwendung als Kanülierungsstelle bei Operationen am offenen Herzen vertraut ist, bietet der perkutane TAx-Ansatz mehrere Vorteile, darunter eine vollständig perkutane Technik, die Durchführbarkeit unter Lokalanästhesie ± Analgosbewusster Sedierung und eine geringere Abhängigkeit von der postoperativen Intensivpflege11,12.Sowohl die linke als auch die rechte A. axillaris chselarterie können für den Zugang verwendet werden; jedoch wird in der Regel die linke Seite bevorzugt, da sie eine günstigere Ausrichtung zum nativen Aortenring bietet und das Risiko einer Beeinträchtigung der Karotisperfusion verringert, was bei Verwendung der rechten A. axillaris chselarterie ein größeres Problem darstellen kann. Für den TAx-Zugang sollte die Arteria subclavia oder axillaris einen Mindestdurchmesser von 5,0 mm aufweisen, ohne schwere Verkalkung, übermäßige Tortuosität, scharfe Angulation am Abgang der A.rteria subclavia oder signifikante Angulation der Aortenwurzel. Basierend auf der CT-Auswertung waren diese anatomischen Kriterien erfüllt, und die Operateure wählten den linken TAx-Zugang als sichere und geeignete alternative Zugangsroute.
4. Auswahl der TAV-Prothese
Die CT-Analyse der nativen Aortenklappe und des linksventrikulären Ausflusstraktes (LVOT) zeigte stark verkalkte Aortenklappen mit schwerer LVOT-Verkalkung. In diesem Zusammenhang ist die Strategie der Vordilatation mit einem Ballon und anschließender Implantation einer selbst-expandierenden TAV-Prothese allgemein anerkannt, da sie bei Patienten mit signifikanter Verkalkung mit einem geringeren Risiko einer Annulsruptur verbunden ist als bei der Verwendung einer ballon-expandierbaren Prothese. Darüber hinaus nutzt diese TAV-Prothese einen aktiven Dichtungsmechanismus durch ihre NaviSeal™-Manschette, einen Skirt, der am Nitinol-Rahmen befestigt ist, aber zwischen den Stentgerüst frei bleibt. Durch diese Konstruktion kann sich die Manschette während der Diastole wie ein Fallschirm oder Windsack ausdehnen, verbleibende Lücken ausfüllen und sich anpassen und so die Abdichtung bei Anatomien mit erheblicher Verkalkung optimieren.
- Seoudy H, Al-Kassou B, Shamekhi J, Sugiura A, Frank J, Saad M, Bramlage P, Seoudy AK, Puehler T, Lutter G, Schulte DM, Laudes M, Nickenig G, Frey N, Sinning JM, Frank D. Frailty in patients undergoing transcatheter aortic valve replacement: prognostic value of the Geriatric Nutritional Risk Index. J Cachexia Sarcopenia Muscle. 2021 Jun;12(3):577-585.
- Huang L, Zhou X, Yang X, Yu H. The impact of preoperative frailty status on outcomes after transcatheter aortic valve replacement: An update of systematic review and meta-analysis. Medicine (Baltimore). 2018 Dec;97(51):e13475.
- Sepehri A, Beggs T, Hassan A, Rigatto C, Shaw-Daigle C, Tangri N, Arora RC. The impact of frailty on outcomes after cardiac surgery: a systematic review. J Thorac Cardiovasc Surg. 2014 Dec;148(6):3110-7.
- Dahle TG, Kaneko T, McCabe JM. Outcomes Following Subclavian and Axillary Artery Access for Transcatheter Aortic Valve Replacement: Society of the Thoracic Surgeons/American College of Cardiology TVT Registry Report. JACC Cardiovasc Interv 2019;12:662-9.
- Overtchouk, P.; Modine, T. Alternate Access for TAVI: Stay Clear of the Chest. Interv. Cardiol. 2018, 13, 145–150.
- Panchal, H.B.; Ladia, V.; Amin, P.; Patel, P.; Veeranki, S.P.; Albalbissi, K.; Paul, T. A meta-analysis of mortality and major adverse cardiovascular and cerebrovascular events in patients undergoing transfemoral versus transapical transcatheter aortic valve implantation using edwards valve for severe aortic stenosis. Am. J. Cardiol. 2014, 114, 1882–1890.
- O’hair, D.P.; Bajwa, T.K.; Popma, J.J.; Watson, D.R.; Yakubov, S.J.; Adams, D.H.; Sharma, S.; Robinson, N.; Petrossian, G.; Caskey, M.; et al. Direct Aortic Access for Transcatheter Aortic Valve Replacement Using a Self-Expanding Device. Ann. Thorac. Surg. 2018, 105, 484–490. [CrossRef] [PubMed]
- Ranka, S.; Lahan, S.; Chhatriwalla, A.K.; Allen, K.B.; Chiang, M.; O'Neill, B.; Verma, S.; Wang, D.D.; Lee, J.; Frisoli, T.; et al. Network Meta-Analysis Comparing the Short- and Long-Term Outcomes of Alternative Access for Transcatheter Aortic Valve Replacement. Cardiovasc. Revasc Med. 2022, 40, 1–10.
- Armstrong, E.J.; Soukas, P.A.; Shammas, N.; Chamberlain, J.; Pop, A.; Adams, G.; de Freitas, D.; Valle, J.; Woo, E.; Bernardo, N.L. Intravascular Lithotripsy for Treatment of Calcified, Stenotic Iliac Arteries: A Cohort Analysis from the Disrupt PAD III Study. Cardiovasc. Revascularization Med. 2020, 21, 1262–1268.
- FFanaroff, A.C.; Manandhar, P.; Holmes, D.R.; Cohen, D.J.; Harrison, J.K.; Hughes, G.C.; Thourani, V.H.; Mack, M.J.; Sherwood, M.W.; Jones, W.S.; et al. Peripheral artery disease and transcatheter aortic valve replacement outcomes: A report from the STS/TVT Registry. Circ. Cardiovasc. Interv. 2017, 10, e005456.
- Chung CJ, Kaneko T, Tayal R, Dahle TG, McCabe JM. Percutaneous versus surgical transaxillary access for transcatheter aortic valve replacement: a propensity-matched analysis of the US experience. EuroIntervention. 2022 Apr 22;17(18):1514-1522.
- Bapat V, Tang GHL. Axillary/Subclavian Transcatheter Aortic Valve Replacement: The Default Alternative Access? JACC Cardiovasc Interv 2019;12:670-2.
- Tomii D, Alaour B, Heg D, Okuno T, Nakase M, Samim D, Praz F, Lanz J, Stortecky S, Reineke D, Windecker S, Pilgrim T. Self-expanding versus balloon-expandable transcatheter heart valves in patients with excessive aortic valve cusp calcification. Am Heart J. 2025 Sep 18;292:107279.
Interessenkonflikte:
Dr. Saad ist Proctor und Berater für Abbott Structural Heart, hat jedoch in diesem Fall keinen Interessenkonflikt.
Offenlegung
In den letzten 36 Monaten erhielt Norman Mangner von Abiomed einen Forschungs- und Ausbildungszuschuss für seine Einrichtung, außerhalb der eingereichten Arbeit; einen Ausbildungszuschuss von Boston Scientific für seine Einrichtung, außerhalb der eingereichten Arbeit; persönliche Honorare von Abbott, Abiomed, Amgen, AstraZeneca, B. Braun, Cordis, Biotronik, Boston Scientific, Edwards Lifesciences, Inari, Medtronic, Pfizer/BMS und Shockwave außerhalb der eingereichten Arbeit.







No comments yet!